Come neve al microscopio

Che il ghiaccio e la neve si sciolgano al sole lo sappiamo tutti. Ma probabilmente ignoriamo che esistono ben 20 forme diverse di ghiaccio, oltre a quella che tutti conosciamo. E che, in particolari condizioni, esiste il “ghiaccio caldo”. La fisica ci mostra come anche una molecola semplice come l’acqua possa rivelare molte sorprese, come scopriamo assieme a Leonardo del Rosso dell'Istituto di fisica applicata “Nello Carrara” del Cnr
È esperienza comune che la neve e in generale il ghiaccio, se scaldati, si sciolgono. Il processo fisico di fusione è reversibile: posso trasformare l’acqua in ghiaccio e viceversa quante volte voglio semplicemente cambiando le condizioni termodinamiche di pressione e di temperatura. Nonostante questo, l’espressione “si scioglie come neve al sole” fa pensare alla irrecuperabilità della situazione originale, soprattutto se si pensa a un fiocco di neve: una volta sciolto è distrutto per sempre.
Insieme a Leonardo del Rosso, ricercatore dell’Istituto di fisica applicata “Nello Carrara” (Ifac) del Consiglio nazionale delle ricerche e studioso della fisica del ghiaccio, scopriamo che una molecola semplice come l’acqua può rivelarci molte sorprese. Ad esempio: perché il ghiaccio galleggia? “Questa è una proprietà anomala che troviamo nell’acqua e in pochissime altre sostanze. Non è l’unica, ma è sicuramente la più nota perché oggetto di esperienza comune, basti pensare al galleggiamento del cubetto di ghiaccio in una qualsiasi bevanda. La densità dell’acqua aumenta, come ci si aspetta, raffreddandola da temperatura ambiente fino a 4°C quando si raggiunge il massimo di densità. Inaspettatamente, diminuendo ancora la temperatura, anche la densità comincia a diminuire. Ciò è dovuto alle orientazioni di particolari legami (legami a idrogeno) tra le molecole di acqua che, nel solido, forzano le molecole a stare più distanti che nel liquido”, spiega del Rosso.
L’acqua, nonostante alcune sue proprietà siano note dal XIX secolo, è ancora oggetto di studio e di acceso dibattito nella comunità scientifica proprio per queste sue anomalie oltre che - naturalmente - per la sua importanza per la vita sulla Terra. Un’altra proprietà sorprendente è legata alle diverse forme cristalline che può assumere nello stato solido (il cosiddetto polimorfismo del ghiaccio): a oggi sono note ben 21, stabili o metastabili; e ancora oggi ne vengono scoperte di nuove. È noto da esperimenti di diffrazione di raggi X, effettuati fin dagli anni '20 del secolo scorso, che la struttura del ghiaccio che si trova naturalmente sulla Terra ha una simmetria esagonale. Questo ghiaccio è chiamato ghiaccio Ih. Questa struttura microscopica si riflette su quella dei fiocchi di neve che crescono dal vapor d’acqua.
“Sugli altri pianeti e satelliti del sistema solare, per esempio, su Titano e su Encelado, satelliti di Saturno, si ritiene che si possano trovare alcune delle altre forme di ghiaccio che gli scienziati hanno prodotto in laboratorio. La maggior parte di queste si ottengono portando l’acqua ad alta pressione, anche senza raffreddarla. È così che, anche a temperatura ambiente, posso ottenere il ghiaccio (cioè acqua solida) che è quindi 'ghiaccio caldo'”, afferma il ricercatore. “Sembra un ossimoro ma non lo è, si ottiene però applicando una pressione di circa 11.000 atmosfere, cosa non banale a farsi. Inoltre, esistono anche ghiacci metastabili, la cui struttura cristallina non corrisponde a una fase stabile dell’acqua e che non si formano spontaneamente a nessuna pressione e temperatura. La metastabilità è un fenomeno comune e non è limitato all’acqua: basti pensare al diamante che è una fase metastabile del carbonio”.
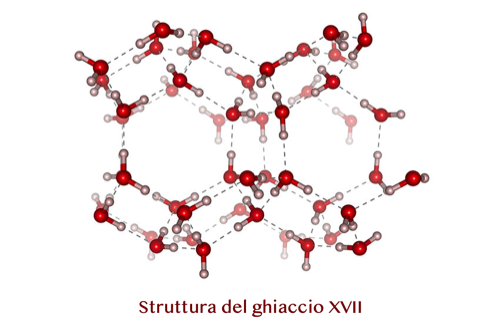
Altre forme si ottengono dalla trasformazione di composti solidi di acqua e gas, per esempio idrogeno, mediante il rilascio di gas. È questo il caso del ghiaccio XVII, oggetto di studio per Leonardo del Rosso e i suoi colleghi del Cnr-Ifac: “Il ghiaccio XVII è di particolare interesse per la sua peculiare struttura cristallina formata da larghi (dal punto di vista microscopico) canali elicoidali che gli conferiscono una natura porosa grazie alla quale è in grado di assorbire e desorbire più volte (teoricamente infinite volte) gas al suo interno senza subire variazioni strutturali", spiega l'esperto. "Questa peculiarità del ghiaccio XVII è dovuta alla modalità in cui è prodotto. Si parte da una miscela di acqua e idrogeno portata ad alta pressione (circa 4.000 atmosfere) e a temperatura di poco inferiore a quella ambiente (circa -20°C). In queste condizioni si forma naturalmente un idrato di idrogeno detto C0, che è la fase stabile di questa miscela. Se viene portato a una temperatura inferiore a 130 K (cioè -143°C), resta in una struttura metastabile anche dopo essere svuotato completamente dalle molecole di idrogeno contenute all’interno dei canali. In questo modo si ottiene il ghiaccio XVII, che è formato solo da molecole di H2O, metastabile a pressione di 1 atmosfera e a una temperatura non superiore ai 130 K".
Ad ogni modo, la proprietà più sorprendente del ghiaccio XVII rimane la sua porosità, aspetto mai visto prima per altre forme di ghiaccio. "Nella pratica, questo ghiaccio poroso può essere utilizzato come materiale per l'immagazzinamento dell'idrogeno per applicazioni energetiche: ne può contenere fino al 50% in proporzione all'acqua (una molecola di idrogeno ogni due di acqua) che corrisponde a più del 5% in peso. Abbiamo inoltre osservato che il ghiaccio XVII assorbe con analoga facilità anche azoto e altri gas, caratteristica promettente per applicazioni nel campo della separazione industriale di gas”, prosegue del Rosso.
A pressione ambiente, oltre al ghiaccio comune Ih, ne esiste anche una versione con una struttura cristallina a simmetria cubica, detta ghiaccio Ic, che è stata osservata come fase intermedia durante la trasformazione, del ghiaccio a pressione ambiente. “Anche il ghiaccio Ic non è una fase stabile dell'acqua solida", chiarisce del Rosso. "Per lungo tempo, molti ricercatori, operanti in diverse parti del mondo, hanno tentato di produrre in laboratorio il ghiaccio cubico strutturalmente puro, ma i numerosi tentativi perseguiti con diverse strategie di sintesi, ad esempio la condensazione di ghiaccio da vapore o il congelamento di nano-gocce di acqua, hanno sempre portato a produrre una via di mezzo tra ghiaccio cubico ed esagonale, ovvero un ghiaccio cubico con consistenti difetti, denominato ghiaccio Isd (stacking-disordered)". Recentemente il gruppo di ricerca al Cnr-Ifac di Sesto Fiorentino è riuscito a ottenere il ghiaccio cubico perfetto, in seguito al progredire degli studi precedenti. "Studiando il ghiaccio XVII a pressione ambiente e sottoponendolo a un lento riscaldamento, si osserva la transizione verso la forma pura di ghiaccio cubico Ic a 140 K. La metastabilità di questa struttura si osserva fino a temperature inferiori a 180 K, oltre le quali il campione si trasforma lentamente nel comune ghiaccio esagonale Ih”, conclude il ricercatore.
Fonte: Leonardo del Rosso, Istituto di fisica applicata “Nello Carrara”, e-mail: l.delrosso@ifac.cnr.it