Simmetria e asimmetria delle molecole
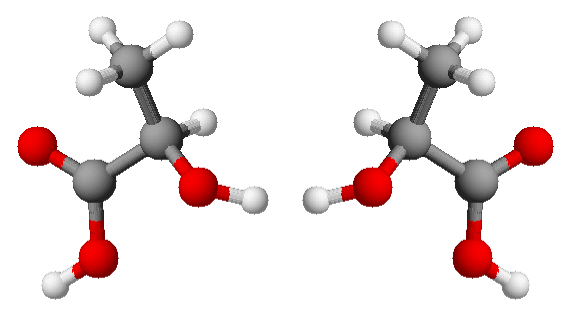
La chiralità, ossia la proprietà geometrica per cui una molecola non è sovrapponile alla sua immagine speculare, costituisce un caso particolare di isomeria, situazione in cui due composti hanno la stessa formula chimica ma sono diversi dal punto di vista della connettività degli atomi e del loro arrangiamento spaziale. A parlarne è Alessia Famengo, ricercatrice dell’Istituto di chimica della materia condensata e di tecnologie per l’energia
La talidomide, farmaco ampiamente utilizzato in passato per curare l’influenza, come sedativo e per alleviare i sintomi della nausea da gravidanza, viene spesso menzionato come caso studio per introdurre i concetti di isomeria e chiralità delle molecole. Considerato inizialmente privo di tossicità, in seguito alla sua ampia diffusione provocò il verificarsi di gravi effetti collaterali, tra questi la nascita di bambini focomelici o con gravissime malformazioni agli arti, figli delle donne che avevano assunto il farmaco durante la gravidanza. La molecola, infatti, esiste in due forme aventi formula identica e con gli atomi legati fra loro nello stesso ordine, l’unica differenza è l’arrangiamento degli atomi nello spazio, per cui una forma è l’immagine speculare dell’altra, ma le due forme non sono sovrapponibili, analogamente a quanto osserviamo confrontando la mano destra con la mano sinistra.
Una forma della talidomide è quella curativa, mentre nell’altra la molecola è tossica teratogena. Questa asimmetria viene definita come la chiralità di una molecola: una molecola è chirale quando è presente in due forme, gli enantiomeri, ciascuno immagine speculare dell’altro, ma non sovrapponibili. Le molecole chirali spesso sono presenti come miscela dei due enantiomeri, dette miscele raceme. Nel caso specifico della talidomide, isolarne la forma “innocua” dal racemo è risultato inefficace, perché il nostro organismo è in grado di convertire un enantiomero nell’altro.
La chiralità è un esempio particolare di isomeria: con il termine isomero, infatti, ci si riferisce sia agli enantiomeri, sia alle molecole che hanno uguale composizione atomica, stesso ordine di atomi legati ma che non sono l’immagine speculare l’uno dell’altra (diastereoisomeri), sia a quelle entità molecolari aventi la stessa composizione atomica ma con gli atomi legati in un ordine diverso (isomeri strutturali).
La tragedia della talidomide ha sicuramente rivoluzionato la chimica farmaceutica, mettendo in primo piano l’analisi delle molecole chirali e la loro separazione nei processi di sviluppo e sintesi di nuovi farmaci. Molti composti di interesse farmaceutico e biologico sono molecole chirali, e spesso un enantiomero è più attivo/reattivo dell’altro. Gli enzimi, i catalizzatori delle reazioni chimiche nei sistemi viventi, sono chirali e sono in grado di distinguere tra due forme enantiomeriche, legandosi ad esempio solo a uno dei due substrati chirali. Gli aminoacidi, i componenti delle proteine, sono molecole chirali e nei sistemi viventi esistono solo nella forma levogira (L), mentre gli zuccheri naturali sono tutti destrogiri (D). La denominazione L e D deriva da una proprietà fisica delle molecole chirali, definita dall’interazione degli enantiomeri con la luce polarizzata: se la molecola ruota il piano di polarizzazione della luce in senso orario è destrogira, se il senso è antiorario è levogira, motivo per cui gli enantiomeri venivano chiamati anche “isomeri ottici”.

Louis Pasteur
Fu Louis Pasteur, uno tra i più grandi ed eclettici scienziati dell’epoca moderna e noto principalmente per le sue ricerche sui vaccini antirabbia e sulla pastorizzazione del latte, a scoprire sperimentalmente la chiralità nelle molecole. Mentre studiava la fermentazione dell’uva osservò che i cristalli di sali dell’acido tartarico potevano essere separati in due gruppi diversi e speculari, rilevando una diversa attività ottica nei due gruppi. Pasteur pubblicò le sue osservazioni tramite un articolo su gli “Annales de Chimie et de Physique” e attraverso il suo famoso intervento alla Società Chimica di Parigi dal titolo “L’asimmetria molecolare”. Fu il primo a dimostrare l’asimmetria molecolare dei sistemi viventi, osservando come il tartarato di ammonio prodotto attraverso la fermentazione dell’acido paratartarico mediata da funghi e muffe fosse di un solo tipo, denominato “sinistro” (L) mentre la forma destra, non stabile, decomponeva. Riconobbe, dunque, il ruolo selettivo dei sistemi viventi nel favorire una sola forma enantiomerica, fenomeno chiamato omochiralità.
L’origine dell’omochiralità nelle molecole biologiche non è ancora stata chiarita, anche se si ritiene che, senza una selezione chirale delle molecole pre-biotiche come aminoacidi e zuccheri, la vita come la conosciamo non sarebbe stata possibile. Nel saggio “Pasteur et la chiralité moleculaire” l’autore Alain Sevin propone un esperimento concettuale: la combinazione aleatoria di un numero n di aminoacidi nelle due conformazioni (D) e (L) (ogni aminoacido si lega in maniera aleatoria ad altri due a dare peptidi o proteine) porta alla formazione di 2n macromolecole diverse. L’elevatissimo numero di molecole possibili combinando 100 aminoacidi (come avviene nella realtà) non sarebbe compatibile con l’evoluzione di sistemi viventi, visto che sarebbe praticamente impossibile fabbricare più copie di una stessa macromolecola, considerato che la vita è basata sulla replicazione molecolare. Le basi azotate che legate formano il Dna e l’Rna, costituite da una base purinica/pirimidinica e lo zucchero D-(deossi) ribosio sono chirali e la stessa elica del Dna è chirale, con la configurazione destrorsa predominante nelle cellule (B-Dna, struttura scoperta da Franklin, Watson e Crick).
Un’affascinante ipotesi che lega geologia e chimica organica correla l’omochiralità con la presenza di alcuni tipi di minerali sulla Terra: particolari forme cristalline (Habitus) dei minerali potrebbero aver favorito, attraverso processi di assorbimento e reazioni alla superficie, uno dei due enantiomeri nelle molecole pre-biotiche, come approfondito nella recente review “Chirality in Organic and Mineral Systems: A Review of Reactivity and Alteration Processes Relevant to Prebiotic Chemistry and Life Detection Missions” pubblicata sulla rivista Simmetry.
Discipline relativamente recenti come l’astrochimica e l’astrobiologia, dedicate all’analisi e allo studio delle reazioni chimiche e dei composti che si formano negli oggetti presenti nel sistema solare, si occupano anche di dare una risposta alla questione dell’omochiralità: ad esempio, nel 1997, Engel e Macko dimostrarono la presenza di un eccesso enantiomerico di amminoacidi-L nel meteorite Murchison, da cui l’ipotesi di un’origine extraterrestre della vita sulla Terra. La ricerca si sta muovendo per cercare di delucidare i meccanismi alla base della selezione enantiomerica, anche se probabilmente passerà ancora molto tempo prima di chiarire quale sia l’origine di questa asimmetria.
Fonte: Alessia Famengo, Istituto di chimica della materia condensata e di tecnologie per l’energia, alessia.famengo@cnr.it